产品规格:
产品数量:
包装说明:
关 键 词:东莞MDRCE认证
行 业:商务服务 认证服务
发布时间:2022-12-27
非级医用防护服、隔离衣、手术衣在MDR中属于普通I类产品,不需要公告机构介入,企业只需通过自我符合性声明的途径进行产品注册,但注册前要完成以下工作
经济运营商(EO)
EO是MDR下的新定义,是指制造商,欧盟授权代表,进口商,经销商和条款22(1) 和22(3)所指的人员;MDR对于EO也提出了更高的要求。制造商也需要考虑一下是否有必要精简自己的EO队伍。
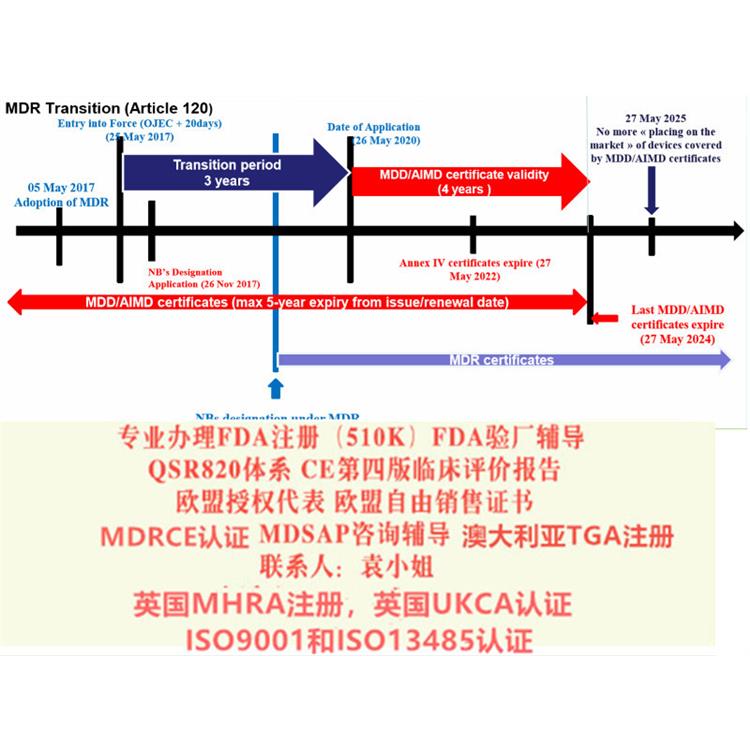
2017年5月5日欧盟发布OfficialJournal在这里我司需要特别说明的是欧盟此次是直接发布的Regulation(法规)而相比较之前的Directive(指令)其区别在于:提高了文件的约束力,发布立即在欧盟成员国生效并成为有约束力的法律,此次的Regulation无需向Directive那样需要经过成员国转化成当地法律法规去落实实施。器械法规(MDR)转换期为3年,2020年5月4日起强制实行。
如果有的话,英国负责人的姓名和地址必须包含在已有UKCA商标的产品标签上。具有CE标志的设备的标签上不必包括英国负责人的详细信息。
十二、完善评价相关要求
新法规提出:
要求根据Article61和附录XIV partA执行、评估、报告和更新评价资料;
提出对特定III类和IIb类器械,CER中要考虑咨询小组的意见;
对植入和III类器械,提出考虑研究;
要求CER按照PMCF取得数据进行更新;
针对III类和可植入器械,提出了CER更新的频率;
明确实质等同性需考虑的特点;
要求其与风险管理的相互作用
十三、Eudamed数据库
新法规提出:
明确欧洲器械数据库(Eudamed)建立目的和包含的信息(Article 33);
信息的公开性:
要求III类器械和植入式器械,和性能信息通过Eudamed向公众开放。
十四、提出器械的可追溯性(UDI)
除定制和研究器械外,其他器械均需建立UDI系统;
UDI信息体现在标签或包装上(不包含集装箱);
UDI-DI信息需要载明于符合性声明中(见Article27);
Annex VI Part B提出UDI-DI包含的信息;
可植入、重复使用、软件、可配置器械的UDI有要求(见Annex VI Part C)
包装或标签上UDI实施的时间见Article123 (f)。
UDI 发行实体由欧盟会。
过渡性:Article 120指出“在会根据第27(2)条发行实体前,GS1、HIBCC和ICCBBA应被视为的发行实体”。
SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括:
协助判定产品分类
协助选择合理的符合性途径
协助选择合适的认证机构
制定认证的解决方案
协助完成评估
编写CE技术文件
欧盟代表服务