马桶椅的SUNGOFDA注册
价格:123.00起
产品规格:
产品数量:
包装说明:
关 键 词:马桶椅的SUNGOFDA注册
行 业:商务服务 认证服务
发布时间:2021-10-16
SUNGO从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾护航。
欧代职责:
1. 代表欧盟非制造商与欧盟主管当局打交道
2. 欧盟代表保存的,贴上CE标志产品的技术文件,确保随时及时的提供给欧盟主管当局审查。
3. 根据非欧盟制造商建立的警戒系统程序,欧盟授权代表协助其进行产品事故报告,召回等
4. 能为客户在欧盟境内销售产品时出现任何问题给予及时的信息沟通与协助解决。
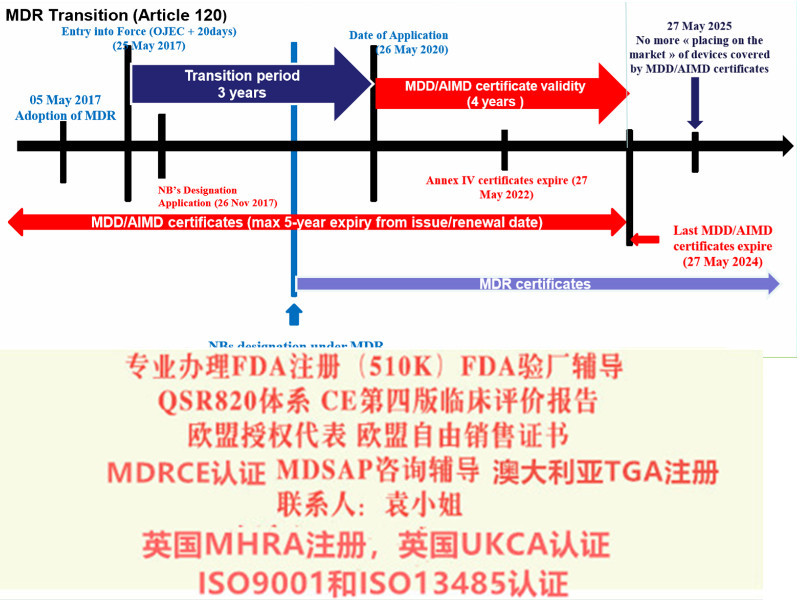
对制造商和产品的影响而言,93/42 EEC指令和MDR基本上具有相同的基本要求。没有现有的需求,但是MDR添加了新的需求,与目前93/42指令相比,MDR更加强调生命周期方法的安全性,并有数据支持。MDR对公告机构的提出了更严格的要求,对国家主管当局和会加强了控制和监测。MDR对某些设备重新分类,范围更广。例如,MDR明确涵盖用于清洁、消毒或消毒其他设备的所有装置(第2.1条);一次性器械(第17条)};和某些无用途的装置(附件十六)。MDR还包括在互联网上销售器械以及用于远程提供诊断或服务的器械(第6条)。MDR为一些Ilb类器械和植入性Il类器械引入了由立小组进行的评估咨询程序(第条)。
加拿大MDEL注册
根据加拿大器械法规(CMDR),按产品风险程度将器械分为 I, II, III和 IV四个等级, 风险等级逐次递增,I类器械为风险,IV类器械风险为。此针对制造者提出的产品注册要求也是逐级增加,要求制造者实行的体系是愈加详尽。
如果您计划进入加拿大市场,则需要进行产品注册登记以获得许可证,加拿大颁发器械机构许可证(MDEL)和器械许可证(MDL)两种不同类型证,并有不同要求
加拿大器械机构许可证(MDEL)
1. 什么是MDEL
MDEL是Medical Device Establishment License 的简称,即器械机构许可证。如果您准备在加拿大生产、进口或分销I类器械,您必须获得加拿大器械机构许可证(MDEL)。MDEL是对于机构的经营许可,无论器械属于哪个类别,器械经销商与进口商都必须获得MDEL许可证。
2. MDEL申请基本流程
(1) 企业为申请Medical Device Establishment License (MDEL)准备相应的文件,
(2) 提交MDEL申请,支付行政收费。
(3) 申请评审通过,将在Health Canada网站公示。
3. 下列几类情况能够豁免 :
(1)零售
(2)企业
(3)在加拿大市场销售企业名下获得器械产品注册证的II类III类和IV类的器械产品的制造厂商 (注:如果是市场销售其他企业名下获得器械产品注册证的II类III类和IV类的器械产品的制造厂商 ,也必须申请办理MDEL )
(4)I类器械产品的制造厂商,根据拥有器械产品营业许可证(MDEL)的企业在加拿大市场销售器械产品 ,则无需申请办理MDEL
4. MDEL的有效期限
MDEL没有标明有效期限 ,但MDEL持有者一定要在每年4月1日前递交年度审核申请,MDEL才被视为继续有效,否则MDEL会被撤销 。
MDEL被撤销后,在加拿大的器械市场销售活动则也会被禁止。如果MDEL被撤销 ,MDEL持有者一定要再次申请办理并缴费,才能够再次获得MDEL,申请成功后,会发放一个新的MDEL许可证。
5. 申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证。
(1) 公司名称及联系方式
(2) 许可文件、邮寄和帐单
(3) 分类和活动表
(4) 场地
(5) 制造商信息
(6)
(7) 签名
SUNGO SUNGO Europe B.V. 可以办理。
SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括:
协助判定产品分类
协助选择合理的符合性途径
协助选择合适的认证机构
制定认证的解决方案
协助完成评估
编写CE技术文件
欧盟代表服务
SUNGO将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、安全进入市场,为器械行业健康发展贡献力量。