产品规格:
产品数量:
包装说明:
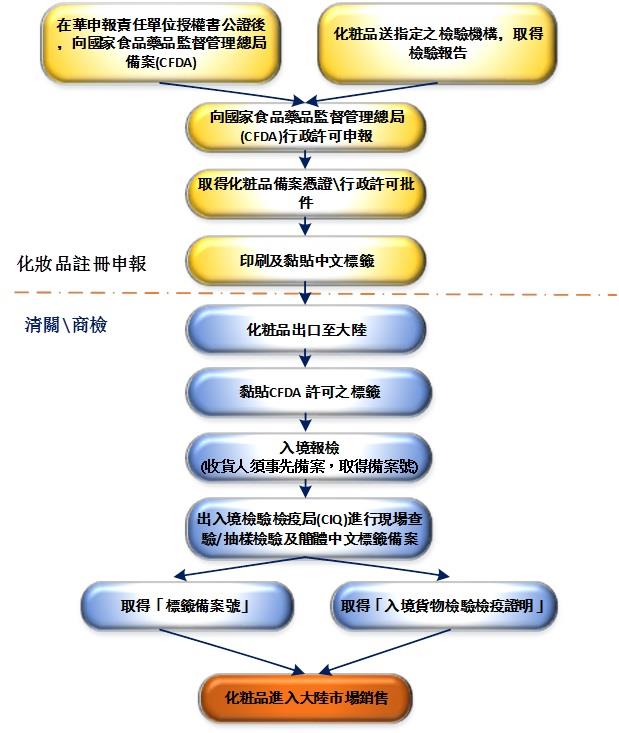
关 键 词:西藏进口化妆品备案程序
行 业:咨询 技术咨询
发布时间:2021-02-22
什么是药妆品?
药妆品的英文(Cosmeceutial) 是由化妆品(Cosmetics) 和药品(Pharmaceutials)两者组成的,意思是指具有药物性质的化妆品,药妆品的属性是化妆品,而不是药品,主要用途是美容护肤和促进皮肤健康,解决轻微肌肤问题。目前国际上对其没有明确的定义。 国外定义药妆品为:介于药物和化妆品之间的制品。国内定义药妆品是以理论为核心思想,突出针对性、性、安全性,具有美容护肤、促进皮肤健康的化妆品。
药妆品的特点有:①具有药物活性,可在正常或近似正常的肌肤上使用;②产品有改善轻微的皮肤异常的效果,如针对红血丝的药妆品;③由于产品针对的是轻度皮肤异常,因此风险性应该极低。
另外,药妆品作为一类功能型化妆品,与普通化妆品不同的是,以理论为(包括西医理论和中医理论),配方设计依据思想,针对皮肤问题和皮肤健康需求设计,具有修复皮肤屏障、抗衰、、降低源等作用,配方尽量精简,不含有或少含有色素、香精、防腐剂、表面活性剂等,并且具有活性成分含量较高、针对性强、显著的特点。
《上海市浦东新区进口非用途化妆品备案管理工作程序(暂行)》解读
八、试点结束后,有何相应工作措施?
备案不同于行政许可,不涉及备案凭证有效期及延续等问题。因此,本《程序》未设置备案有效期延续等相关要求。
根据《关于在上海市浦东新区暂时调整有关行政法规和文件规定的行政审批等事项的决定》(国发〔2016〕24号)要求,试点实施的截止日期为2019年12月21日。试点结束后,食品药品总局将及时总结试点工作经验,提出相关法规的修订建议,并修订完善相关部门规章,以便适时在全国范围内推广。
进口非特化妆品备案的相关法规汇总
一、关于在全国范围实施进口非用途化妆品备案管理有关事宜的公告(2019年第88号)
二、国家总局关于发布上海市浦东新区进口非用途化妆品备案管理工作程序(暂行)的公告(2019年第10号)
三、总局办公厅关于明确浦东新区试点实施进口非用途化妆品备案检验报告要求等有关事宜的通知(办药化管〔2019〕72号)
四、根据《总局关于在更大范围试点实施进口非用途化妆品备案管理有关事宜的公告》(2019年第31号),扩大的10个自贸区为:天津、辽宁、浙江、福建、河南、湖北、广东、重庆、四川、陕西。
五、《化妆品行政许可检验规范》
六、《化妆品行政许可申报受理规定》
上海市浦东新区进口非用途化妆品备案管理工作程序(暂行)
为规范在上海市浦东新区申报进口的进口非用途化妆品备案工作,提高备案工作效率,特制定本工作程序。本工作程序适用于以备案方式从上海市浦东新区口岸进口且境内责任人注册地在上海市浦东新区的进口非用途化妆品。
一、境内责任人授权
拟按本工作程序申请进口非用途化妆品备案的化妆品生产企业,应当授权注册地在浦东新区的企业法人作为境内责任人,负责产品的进口和经营,并依法承担相应的产品质量安全责任。境内责任人授权应当明确具体范围,同一产品不得由不同的境内企业法人作为境内责任人。
二、备案系统用户名称注册
境内责任人在申报进口非用途化妆品备案前,应当通过备案系统报送以下资料进行用户注册:
(一)加盖境内责任人公章、并由其负责人签字的进口非用途化妆品备案管理系统用户名称注册申请书;
(二)生产企业对境内责任人的授权书及其公,授权书为外文的,还应译成中文,并对翻译件与原件一致进行公证;
(三)境内责任人营业执照。
系统审核通过后,境内责任人应持与电子版一致的纸质版资料至上海市食品药品部门领取备案系统用户名称和初始密码。
三、产品备案信息报送
境内责任人应当在产品进口前,对产品的安全性相关资料进行整理、归档,通过备案系统上传下列资料:
(一)进口非用途化妆品备案申请表(在线填报);
(二)产品中文名称命名依据(在线填报);
(三)产品配方(在线填报);
(四)产品质量安全控制要求;
(五)产品原包装(含产品标签、产品说明书)图片;拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书);
(六)产品生产工艺简述;
(七)产品技术要求;
(八)化妆品行政许可检验机构出具的检验报告及相关资料;
(九)产品中可能存在安全性风险物质的有关安全性评估资料;
(十)化妆品适用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书;
(十一)产品在生产国(地区)或原产国(地区)生产和销售的文件;
(十二)生产企业生产质量管理的相关材料;
(十三)参照《化妆品行政许可申报受理规定》(国许〔2009〕856号,以下称《申报受理规定》)要求,可能有助于备案的其他资料。
电子版资料填报上传完成后,境内责任人应持与电子版一致的纸质版资料至上海市食品药品部门办理备案。上述资料原件(检验报告、公证文书、文件及第三方文件除外)应由境内责任人逐页加盖公章或骑缝章。
四、备案信息凭证的生成
上海市食品药品部门收到产品备案资料(含纸质及电子版资料)后,应当对产品是否属于备案范围、备案资料是否完整、备案资料是否符合规定形式等方面进行核对。符合要求的,予以备案,产品备案信息在食品药品总局政务统一公布,供公众和相关进出口部门查询。不符合要求的,应当告知境内责任人并说明理由。
备案信息系统将自动生成电子版备案信息凭证,境内责任人可自行下载、打印。备案产品按照“国妆网备进字(沪)+四位年份数字+六位顺序编号”的规则进行编号。
五、备案资料的监督检查
上海市食品药品部门应当在产品备案后3个月内,组织开展对备案资料的监督检查,重点检查产品配方、生产工艺、检验项目、安全性风险评估等是否符合安全性相关要求,必要时进行现场监督检查。
发现以下不符合要求情形的,应当要求境内责任人在30日内一次性补充提交相关资料:
(一)产品中文名称中存在个别不规范文字或汉语拼音名缺失、拼写错误的;
(二)产品设计包装(含产品标签、产品说明书)中个别文字内容缺失或书写不规范的;
(三)产品配方中相关信息明确,但个别原料中文名称、INCI名拼写错误,或着色剂CI号缺失的;
(四)其他无须进行实质性修改,通过提供补充解释说明性资料或需对个别文字拼写错误进行修改便可符合审核要求的。
发现依据现有资料无法判断产品安全性的,应当告知境内责任人补充提交相关资料,在确认备案资料符合要求前暂停进口及销售该产品。
发现存在违法情形或产品质量安全问题的,应当依法查处,并对相关产品进行责令下架、召回处理。
六、备案信息变更和注销
已经按本工作程序备案的产品,拟变更原备案事项(产品配方除外)的,应当将相关变更内容和资料重新报送,并参照《申报受理规定》要求提交其他相关资料。涉及境内责任人主体改变的,还应同时提交变更前境内责任人的知情同意书,以及变更后境内责任人承担产品(含变更前已上市的产品)质量安全责任的承诺书。
已备案产品不再进口的,境内责任人应当主动注销原备案信息。
七、与现行工作程序的衔接
不属于本工作程序适用范围的进口非用途化妆品,应当按照现行相关法规要求,申报进口非用途化妆品行政许可,获得批准后方可办理进口手续。
属于本工作程序适用范围的进口非用途化妆品,可选择行政许可或备案的方式进口。已按本程序备案的产品,后续需要自其他口岸进口的,应当注销备案产品信息,按照现行法规要求申报进口非用途化妆品行政许可,获得批准后方可进口。按照现行相关法规要求,已获进口非用途化妆品行政许可,在许可有效期内自浦东口岸进口的,无须按本程序重新办理备案相关手续;行政许可有效期结束未申请延续或已注销行政许可的,可按本程序办理备案。申请进口非用途化妆品行政许可不予批准的产品,不得按本程序办理备案。已按本程序备案进口的产品,产品的中文标签上应标注备案编号。
各级食品药品部门应当重点加强对备案产品的上市后监督检查,督促化妆品经营企业严格执行索证索票和进货查验制度,发现存在涉嫌违法违规行为的,依法进行调查处理。
附:1.进口非用途化妆品备案管理系统企业用户名称注册申请书(式样);2.进口非用途化妆品备案境内责任人授权书(式样)
附1:进口非用途化妆品备案管理系统企业用户名称注册申请书(式样)
根据《关于在上海市浦东新区试点实施进口非用途化妆品备案管理有关事宜的公告》(2019年第7号)要求,我企业现申请开通进口非用途化妆品备案管理系统企业用户账号,请予批准。在此作出以下郑重声明:
一、承诺所填报信息和提交的材料真实、完整。如有不实之处,我企业将承担相应法律责任及由此造成的一切后果。
二、我企业作为××××××(授权方名称)×××××××(授权范围)的进口非用途化妆品备案境内责任人,承诺对我企业备案的进口非用途化妆品承担质量安全责任。如产品存在质量安全问题,我企业将承担相应法律责任及由此造成的一切后果。
企业名称(签章)
法定代表人(签字)
年月日
附2:进口非用途化妆品备案境内责任人授权书(式样)
经双方协商一致,现就进口非用途化妆品备案境内责任人授权有关事宜明确如下:
授权方:
被授权方:
授权范围:
授权时限:
授权方(签章): 被授权方(签章):
负责人(签字): 法定代表人(签字):
地址: 地址:
联系方式: 联系方式:
年 月 日 年 月 日
解读关于在全国范围实施进口非用途化妆品备案管理有关事宜的公告(2019年第88号)
3)现场备案资料提交
境内责任人注册地在天津、辽宁、上海、浙江、福建、河南、湖北、广东、重庆、四川、陕西,向所在地省级食品药品监督管理部门办理备案。
境内责任人注册地在其他省(区、市)行政区域范围内的,在网上备案系统填报上传完成电子版资料后,向国家药品监督管理部门办理备案。