产品规格:
产品数量:
包装说明:
关 键 词:法国进口化妆品备案多久
行 业:咨询 技术咨询
发布时间:2020-11-19
解读关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告(2019年第88号)
变更背景
1)这个政策的变更可以追溯到2019年3月1日发布的《关于在上海市浦东新区试点实施进口非特殊用途化妆品备案管理有关事宜的公告》(2019年第7号),首先在上海浦东试点改革,已经有意将进口非特殊用途化妆品备案权利下放。
申报材料要求
(1)首次申请非特殊用途化妆品行政许可提交申报资料原件 1 份。
(2)除检验报告、公证文书、官方证明 文件及第三方证明文件外,申报资料原件应 由申请人逐页加盖公章或骑缝章;进口化妆 品(新原料)申报资料原件还应由行政许可在华申报责任单位逐页加盖行政许可在华申报责任单位公章或骑缝章。
解读关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告(2019年第88号)
1:核心内容:
进口非特殊用途化妆品采用备案管理机制,实行全国统一备案管理,取消进口非特殊用途化妆品行政许可申请。
进口化妆品生产企业应当在产品进口前,委托境内责任人,通过“进口非特殊用途化妆品备案管理系统”网络平台,办理备案手续。
境内责任人注册地在天津、辽宁、上海、浙江、福建、河南、湖北、广东、重庆、四川、陕西,现场备案在所在地省级食品药品监督管理部门办理,其余地区,向国家药品监督管理部门办理备案。
2:变更背景
1)这个政策的变更可以追溯到2019年3月1日发布的《关于在上海市浦东新区试点实施进口非特殊用途化妆品备案管理有关事宜的公告》(2019年第7号),首先在上海浦东试点改革,已经有意将进口非特殊用途化妆品备案权利下放。
2)接着在2019-03-14发布了《关于在更大范围试点实施进口非特殊用途化妆品备案管理有关事宜的公告》,扩大了试点实施进口非特殊用途化妆品备案管理工作的试验区,包括天津、辽宁、浙江、福建、河南、湖北、广东、重庆、四川、陕西10个自贸试验区,进一步加大了备案权利下放的力度。
紧接着2019年10月10号,国务院发布了《关于在全国推开“证照分离”改革的通知》(国发〔2019〕35号),文中列明了关于106项行政事项的改革举措,其中关于化妆品提出首次进口非特审批改为备案,且明确了各地区部门需在2019年11月10日前将具体措施报送市场监管总局备案,同时向社会公开。
3)后就是本文要讲的主题,2019年11月9号发布的《关于在全国范围实施进口非特殊用途化妆品备案管理有关事宜的公告》(2019年第88号),自2019年11月10日起,首次进口非特殊用途化妆品由现行审批管理和自贸试验区试点实施备案管理,调整为全国统一备案管理,国家药品监督管理部门不再受理进口非特殊用途化妆品行政许可申请。
3:新政内容解读
1)全国统一备案管理,不再受理进口非特殊用途化妆品行政许可申请。
自2019年11月10日起,首次进口非特殊用途化妆品由现行审批管理和自贸试验区试点实施备案管理,调整为全国统一备案管理,国家药品监督管理部门不再受理进口非特殊用途化妆品行政许可申请。
2)网上备案申请:
进口化妆品生产企业应当在产品进口前,委托境内责任人登录国家药品监管局政务“网上办事”栏目,通过“进口非特殊用途化妆品备案管理系统”网络平台,办理备案手续,取得电子版备案凭证后方可进口。备案产品按照“国妆网备进字(境内责任人所在省份简称)+四位年份数字+六位顺序编号”的规则进行编号。
3)现场备案资料提交
境内责任人注册地在天津、辽宁、上海、浙江、福建、河南、湖北、广东、重庆、四川、陕西,向所在地省级食品药品监督管理部门办理备案。
境内责任人注册地在其他省(区、市)行政区域范围内的,在网上备案系统填报上传完成电子版资料后,向国家药品监督管理部门办理备案。
4)进口口岸不在受限
已经备案产品,不仅可以在责任人注册地所在区域口岸进口,还可在其他省市的口岸进口,仅需要通过备案系统补充填报进口口岸和收货人等相关信息即可。
5)备案信息及检验等事宜,需按要求进行准备
申请进口非特殊用途化妆品备案的进口化妆品生产企业,应当参照原食品药品监管总局发布的《关于发布上海市浦东新区进口非特殊用途化妆品备案管理工作程序(暂行)的公告》(2019年 第10号)相关要求,进行境内责任人授权、备案系统用户名称注册、产品备案信息报送、备案信息凭证打印等相关工作。
关于进口非特殊用途化妆品检验报告、境内化妆品企业委托境外企业生产等有关事宜,参照原食品药品监管总局办公厅《关于明确浦东新区试点实施进口非特殊用途化妆品备案检验报告要求等有关事宜的通知》(食药监办药化管〔2019〕72号)执行。
6)审批中的化妆品可以继续原来的流程,亦可以撤回,按新规定申报
2019年11月10日前申报行政许可且已被国家药品监督管理部门受理的进口非特殊用途化妆品,申报单位可在2019年11月20日前向国家药品监督管理部门撤回原行政许可申请,后续由境内责任人按照本公告相关要求备案进口。逾期未撤回的,国家药品监督管理部门将按照原程序继续开展技术审核,符合要求的核发纸质版进口非特殊用途化妆品备案凭证。
2019年11月10日前申请进口非特殊用途化妆品行政许可尚未取得批件的产品,后续可按照本公告相关要求办理备案,涉及产品安全性原因未获批准的除外。
7)已获进口非特殊用途化妆品行政许可,可继续使用,过期后需重新办理
按照原审批管理相关法规要求,已获进口非特殊用途化妆品行政许可,在许可有效期内可继续持国家药品监督管理部门核发的纸质版凭证办理进口,期间需要补发或纠错凭证的,按原有规定办理。
在许可有效期结束后仍需继续进口,或者有效期结束前原行政许可事项发生变更的,应当按照本公告要求重新办理备案手续后方可进口。
8)加强监管:
监管力度、各级药品监管部门应当加大备案进口产品的事中、事后监管力度,加强与海关等有关部门的协调配合,及时通报产品质量安全信息,会同有关部门依法查处相关违法违规行为
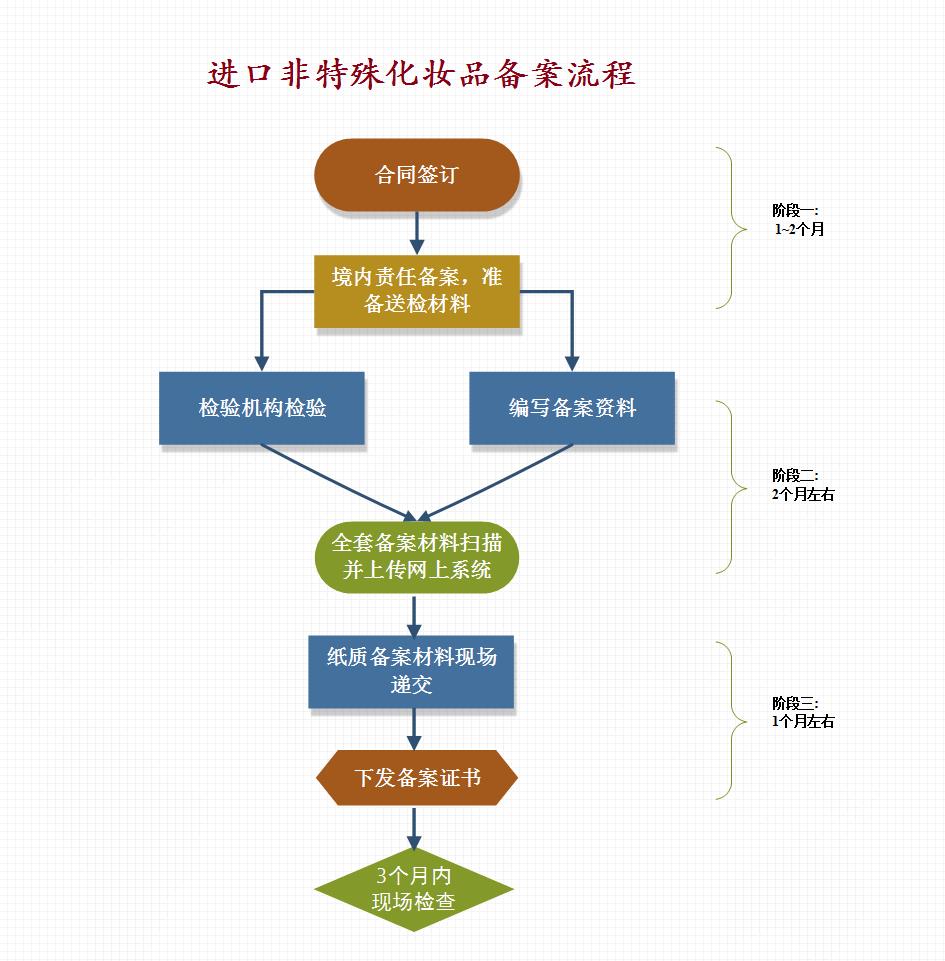
3. 新旧政策流程对比图
详见->
4.主要影响
1)简化流程,节省行政审批时间。
审核通过后,境内责任人应持与电子版一致的纸质版资料至上海市食品药品监管部门领取备案系统用户名称和初始密码。
2)境内责任人承担更大的责任
境内责任人的资质要求更加严格,经营范围有明确要求,需要涵盖进口和经营化妆品,而在华申报责任单位,只需要具有独立法人资格即可;境内责任人承担的责任和风险更大,负责产品的进口和经营,并依法承担相应的产品质量安全责任;在华申报责任单位只承担产品申报责任;另外,境内责任人授权应当明确具体范围,同一产品不得由不同的境内企业法人作为境内责任人。
3)责任人注册地如果在上面提到的11个自贸区,则需向当地省局指定窗口递交纸质版资料;如果注册地在11个自贸区以外,仍需向总局递交纸质资料,但是一定要先完成线上的资料递交。
4)如果已经由在华责任申报单位完成行政许可检验,检验报告仍可用于备案,但是需要交一份情况说明,以及前在华的知情同意书。
进口非特殊化妆品审批指南
作者:汇诚佳业
主管部门:国家食品药品监督管理总局
检测机构:化妆品行政许可检验机构(卫生安全性检验机构、人体安全性检验机构)
一、进口非特殊化妆品定义:
后一道接触内容物的(分装/罐装)工序在境外(含港澳台)完成的,不在育发、染发、烫发、脱毛、美乳、健美、除臭、祛斑(含美白)、防晒特殊用途范围内的其他化妆品。
二、进口非特殊化妆品申报流程图
汇诚佳业取得批件合理时间(从送检开始至取得批件)是:5.5-6.5个月
三、 进口非特殊化妆品申报详细流程
1、 准备授权文件及相关公证件(在华申报责任单位授权、接受授权、签字授权等)
2、 向国家食品药品监督管理局行政受理服务大厅提交在华责任单位备案资料。
3、 在国家食品药品监督管理总局化妆品申报系统中注册企业用户名和密码
4、 按照《化妆品行政许可检验管理办法》确定检验项目
5、 准备样品(数量、净含量均满足检验要求),填写检验申请表,一并送至检验机构进行检验。
6、 领取检验报告
7、按照《化妆品行政许可申报受理规定》要求,准备产品申报资料
8、将完整的申报资料送至国家食品药品监督管理总局行政受理服务大厅
9、等待产品审核结果
10、领取批件
四、申报资料清单
(一)进口非特殊用途化妆品行政许可申请表;
(二)产品中文名称命名依据;
(三)产品配方;
(四)产品质量安全控制要求;
(五)产品原包装(含产品标签、产品说明书);拟专为中国市场设计包装的,需同时提交产品设计包装(含产品标签、产品说明书);
(六)经国家食品药品监督管理总局认定的许可检验机构出具的检验报告及相关资料;
(七)产品中可能存在安全性风险物质的有关安全性评估资料;
(八)已经备案的行政许可在华申报责任单位授权书复印件及行政许可在华申报责任单位营业执照复印件并加盖公章;
(九)化妆品使用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书;
(十)产品在生产国(地区)或原产国(地区)生产和销售的证明文件;
(十一)可能有助于行政许可的其他资料;
(十二)生产工艺简述和简图;
(十三)产品技术要求的文字版和电子版。
另附许可检验机构封样并未启封的市售样品1件。
五、申报材料要求
(1)首次申请非特殊用途化妆品行政许可提交申报资料原件 1 份。
(2)除检验报告、公证文书、官方证明 文件及第三方证明文件外,申报资料原件应 由申请人逐页加盖公章或骑缝章;进口化妆 品(新原料)申报资料原件还应由行政许可在华申报责任单位逐页加盖行政许可在华申报责任单位公章或骑缝章。
(3)使用 A4 规格纸张打印,使用明显区分标志,按规定顺序排列,并装订成册。
(4)使用中国法定计量单位。
(5)申报内容应完整、清楚,同一项目 的填写应当一致。
(6)所有外文(境外地址、网址、注册 商标、专利名称、SPF、PFA 或 PA、UVA、 UVB 等必须使用外文的除外)均应译为规范的中文,并将译文附在相应的外文资料前。
(7)终止申报后再次申报的,还应说明终止申报及再次申报的理由;不予行政许可后再次申报的,应提交不予行政许可(变更/ 延续)决定书复印件,并说明再次申报的理由,同时还应提交不予行政许可原因是否涉及产品安全性的书面说明。
(8)产品配方应提交文字版和电子版。
(9)文字版和电子版的填写内容应当一致。
(10)生产和销售证明文件、质量管理体系或良好生产规范的证明文件、不同国家 的生产企业同属一个集团公司的证明、委托 加工协议等证明文件可同时列明多个产品。 这些产品如同时申报,一个产品使用原件, 其他产品可使用复印件,并书面说明原件所在的申报产品名称;这些产品如不同时申 报,一个产品使用原件,其他产品需使用 经公证后的复印件,并书面说明原件所在 的申报产品名称。
(11)产品技术要求电子版应登录国家食品药品监督管理总局化妆品行政许可网 上申报系统填写。
(12)进口化妆品首次申报时应提交产品 在生产国(地区)或原产国(地区)生产和销售的证明文件。
六、进口非特化妆品申报第三方收费及样品数量
产品分类
基础检验费
(单位:RMB/种)
检验样品数量
护肤
发用产品
7300
≥25g/ml,24个
一般护肤产品
6300
≥25g/ml,24个
易触及眼睛的护肤产品
8300
≥25g/ml,24个
彩妆品
一般彩妆品
6300
≥25g/ml,24个
眼部彩妆品
8300
≥25g/ml,24个
护唇及唇部彩妆品
6300
≥25g/ml,24个
香水、洗手液、指(趾)甲用品、发蜡发乳产品
5300
≥25g/ml,24个
婴幼儿、儿童、孕妇化妆品
6300
≥25g/ml,24个
根据产品具体情况可能会产生以下费用:
1、加测项目检测费用,常见如:二恶烷,二甘醇,甲醇,苯酚,丙烯酰胺,需要1000-2000元不等。
2、公正翻译费用:如:接受授权书签字盖章公正,授权书,自由销售证明译文公正及ISO影印件一致公正,需要1000左右。