福州进口化妆品申报指南咨询 欢迎来电垂询
价格:4000.00起
产品规格:
产品数量:
包装说明:
关 键 词:福州进口化妆品申报指南咨询
行 业:咨询 技术咨询
发布时间:2020-03-22
进口化妆品都需要向国家药监局备案。化妆品备案的流程如何呢?汇诚佳业咨询师撰文,希望对大家有所帮助。如果有什么不明白的,欢迎和笔者联系:
联系人:马小姐(Tammy)(汇诚佳业国际企业管理有限公司)
电话:
座机:-
网上咨询:
一、何种化妆品由国家药监局备案?
答: 所有进口化妆品必须向药监局备案。
二、药监局审批(备案) 的程序是怎样的?
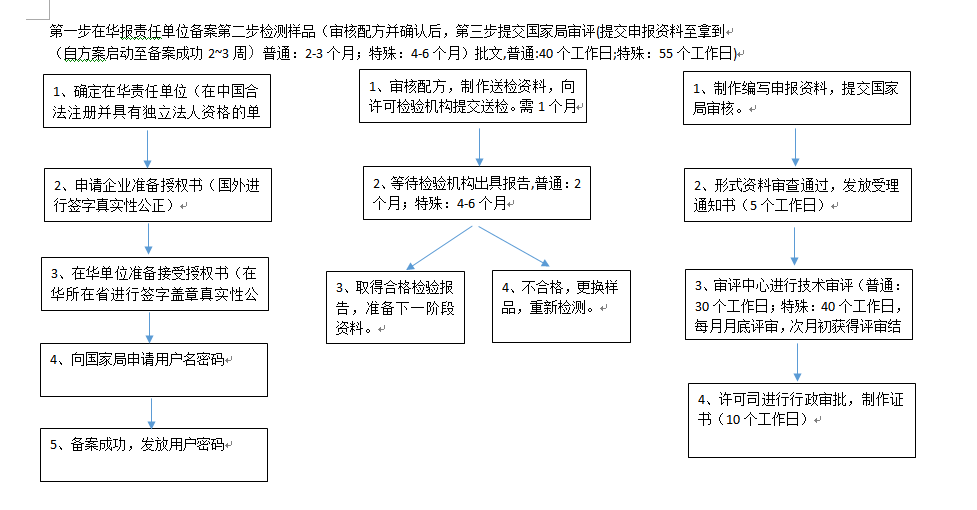
答: 1、进口普通化妆品的备案程序:在华申报责任单位备案,检验、整理材料、申请备案、材料审核、核发备案凭证等程序。
三、申请批件需要多长时间
答:进口普通类化妆品一般在5-6个月左右取得批文,进口特殊类化妆品一般在10个月左右取得批文。化妆品备案时间主要体现在以下几个方面:
1、检验时间:
进口普通类化妆品检验周期,一般在2个月内完成。特殊用途化妆品的各项试验的检测周期,一般在3-4个月内完成。防晒类产品如果加做SPF值、斑贴试验及PA试验,时间需要适当延长。育发类、健美类、美乳类产品需要做人体试用试验安全性评价,整个周期约为150天。
2、评审时间:
普通产品转到审评中心即审核备案。特殊用途化妆品的评审会议为每月10号之前受理,最后一周上会。
四、化妆品许可评审依据?
答:化妆品卫生许可审批工作按《化妆品安全技术规范 (2015年版)》和化妆品行政许可申报受理规定,化妆品技术审评要点。
五、化妆品备案一般需要多少费用?
答:化妆品备案费用主要是化妆品的检验费用
检验收费标准会根据产品的类别有所不同:普通化妆品一般在4000-7800元,多数都是6300元/个,特殊类化妆品因会增加人体试验而稍高,大多在10000元以上,但一般不超过3.5万。
代理机构服务费:.随着国家对化妆品监管力度的加大,这项工作技术含量越来越高,建议国外生产企业和代理商还是找专业人士来为大家服务。汇诚佳业国际企业管理有限公司。专业代理化妆品批文办理,成功备案日本,韩国,美国,台湾,香港,瑞士,意大利,法国等多个国际产品。欢迎和我们联系。电话:,联系人:马小姐
六、化妆品的检验需要进行哪些检测项目?
答:化妆品一般要进行微生物检验、卫生化学检验、pH值测定、毒理学安全性实验、人体安全及功能试验。
检验时间一般在2-4个月,有些特殊功能化妆品因为要做人体试验,时间稍长。
七、化妆品备案涉及的机构有哪些?
答:化妆品的备案,主要涉及到四个机构:1、检测机构;2、行政受理中心;3、评审委员会;4、行政审批部门。
八、备案进口化妆品需提交哪此材料?
答:(一)进口非特殊用途化妆品行政许可申请表;
(二)产品中文名称命名依据;
(三)产品配方;
(四)产品质量安全控制要求;
(五)产品原包装(含产品标签、产品说明书);拟专为中国市场设计包装的,需同时提交 产品设计包装(含产品标签、产品说明书);
(六)经国家食品药品监督管理局认定的许可检验机构出具的检验报告及相关资料;
(七)产品中可能存在安全性风险物质的有关安全性评估料;
(八)已经备案的行政许可在华备案责任单位授权书复印件及行政许可在华备案责任单位营业执照复印件并加盖公章;
(九)化妆品使用原料及原料来源符合疯牛病疫区高风险物质禁限用要求的承诺书;
(十)产品在生产国(地区)或原产国(地区)生产和销售的证明文件;
(十一)可能有助于备案的其他资料。
另附许可检验机构封样并未启封的市售样品1件。
九、需要提供的证明性材料有哪些?
答:主要为以下2种:
1、自由销售证明原件,非中文,需要进行翻译公证。
2、授权书
第一种如为外文的需要进行翻译公证,后一种需要就委托方和被委托方的法人签字和盖章分别在各自的所在国进行真实性公证,经过双方公证后的授权书如果非中文,需要翻译公证。
毒理学试验:普通化妆品需要做急性皮肤刺激性试验、急性眼刺激性试验、多次皮肤刺激性试验;特殊用途化妆品除以上三项试验外,还需要做皮肤变态反应试验、皮肤光毒性试验、回复突变试验、体外哺乳动物细胞染色体畸变试验;
汇诚佳业国际企业管理有限公司一直致力于进口化妆品备案凭证(行政许可批件)的代理申报工作,多年的申报经验和您一起分享。为您加快审批进程,缩短申报时间,提高申报效率,抢占中国市场的提供指导。
联系人:马小姐(汇诚佳业国际企业管理有限公司)
24小时免费咨询专线:-,
网上咨询: ;Email:
地址:海淀区建材城东路新龙大厦A座706室
首次申请化妆品新原来技术要求
(一) 申请材料目录
1.化妆品新原料行政许可申请表;
2.研制报告;
3.生产工艺简述及简图;
4.原料质量安全控制要求;
5.毒理学安全性评价资料;
6.代理申报的,应提交已经备案的行政许可在华申报责任单位授权书复印件及行政许可在华申报责任单位营业执照复印件并加盖公章;
7.可能有助于行政许可的其他资料。另附送审样品 1 件。
(二) 申报资料的一般要求
1.提交申报资料原件1份、复印件4份,复印件应清晰并与原件一致。
2.除检验报告、公证文书、官方证明文件及第三方证明文件外,申报资料原件应由申请人逐页加盖公章或骑缝章;进口化妆品 (新原料) 申报资料原件还应由行政许可在华申报责任单位逐页加盖行政许可在华申报责任单位公章或骑缝章。
3.使用 A4 规格纸张打印,使用明显区分标志,按规定顺序排列,并装订成册。
4.使用中国法定计量单位。
5.申报内容应完整、清楚,同一项目的填写应当一致。
6.所有外文(境外地址、网址、注册商标、专利名称、SPF、PFA 或 PA、UVA、 UVB 等必须使用外文的除外) 均应译为规范的中文,并将译文附在相应的外文资料前。
7.终止申报后再次申报的,还应说明终止申报及再次申报的理由;不予行政许可后再次申报的,应提交不予行政许可(变更/延续)决定书复印件,并说明再次申报的理由,同时还应提交不予行政许可原因是否涉及产品安全性的书面说明。
8.文字版和电子版的填写内容应当一致。
(三) 申报资料的具体要求
1.逐项提交各项资料。
2.应按照申请表填表说明的要求填写申请表各项。行政许可申请表保证书应由进口化妆品生产企业或进口化妆品新原料生产企业法定代表人或其授权的该生产企业的签字人或其授权的行政许可在华申报责任单位的签字人签字;无公章的,应在保证书生产企业签章处予以注明。行政许可申请表承诺书应由行政许可在华申报责任单位法定代表人或法定代表人授权该单位的签字人签字并加盖行政许可在华申报责任单位公章。授权委托签字时,应提供授权委托书证件及其中文译文,并做中文译文与原文内容一致的公证。根据《资料要求》第二十四条的要求,在每次提交行政许可申请时应同时提交授权委托书原件或经公证后的复印件,并书面说明委托签字授权书原件所在的申报产品名称。授权委托签字的内容不应包含于行政许可在华申报责任单位授权书中。
-/gjcidc/-