手动移位机2017/745 MDR CE技术文件 医疗器械MDR法规
价格:面议
产品规格:
产品数量:
包装说明:
关 键 词:手动移位机2017/745
行 业:咨询 管理咨询
发布时间:2023-10-20
MDR还包括在互联网上销售器械以及用于远程提供诊断或服务的器械(第6条)。MDR为一些Ilb类器械和植入性Il类器械引入了由立小组进行的评估咨询程序(第54条)。
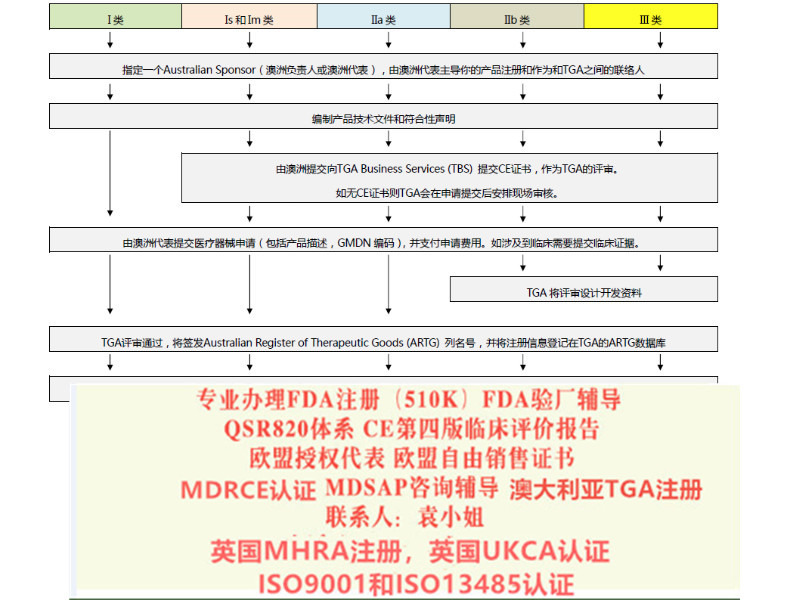
关于MDR 涵盖产品范围和分类规则法规对“器械”的定义结合了90/385/EEC 和93/42/EEC 指令的范围,并有所扩大,纳入了有源植入器械、软件以及植入或侵入人体的非用途产品,如眼镜、美容植入物、去除脂肪组织的器械、发射高强度电磁进行皮肤等操作的器械、利用磁场大脑元活动的器械等。对药械组合产品的描述也更为具体,法规还适用于使用活性或非活性动物、人源组织或细胞的产品制造而成的器械。器械的分类仍延续了之前的大类,即按照风险等级分为类:Ⅰ、Ⅱ a、Ⅱ b、Ⅲ类。但分类规则较之前有所增加,由18 条增加至22 条。具体分类规则条款情况及变化情况见下表2:欧盟器械新法规MDR主要变化情况介绍
2017年5月,欧盟会提出了新的器械法规,参考法规(EU)2017/745(以下简称:MDR2017/745)。
上市后跟踪的规定,要求制造商主动收集和评估上市后数据,旨在确认器械的有效性、识别之前未知的并已识别的和禁忌症、识别并分析突发风险、确保收益/ 风险的可接受性以及确定器械可能的操作不当或超标示使用以验证其预期用途是否正确。上市后跟踪在产品生命周期中的作用不可忽视。
可以为某些设备制定确定附加要求的通用规范(第9条)。器械法规(MDR)何时适用MDR(EU)2017/745将于2020年5月26日起申请 - “申请日期”(DoA)。MDR的某些条款将提前生效(例如关于公告机构和器械协调组)。 有些将在稍后申请(例如关于UDI标签)。
选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。我们将秉承一贯“服务、客户”的原则,依托的技术团队,优化我们的服务,让更多的器械合法、进入市场,为器械行业健康发展贡献力量。