丁腈手套UK REP注册 英国代表 UK REP是什么
价格:面议
产品规格:
产品数量:
包装说明:
关 键 词:REP注册,丁腈手套UK
行 业:咨询 管理咨询
发布时间:2023-08-31
英国已经脱欧了,不再认可欧洲的CE证书,需要UKCA认证,有英代,MHRA注册,才可以合规出口英国。
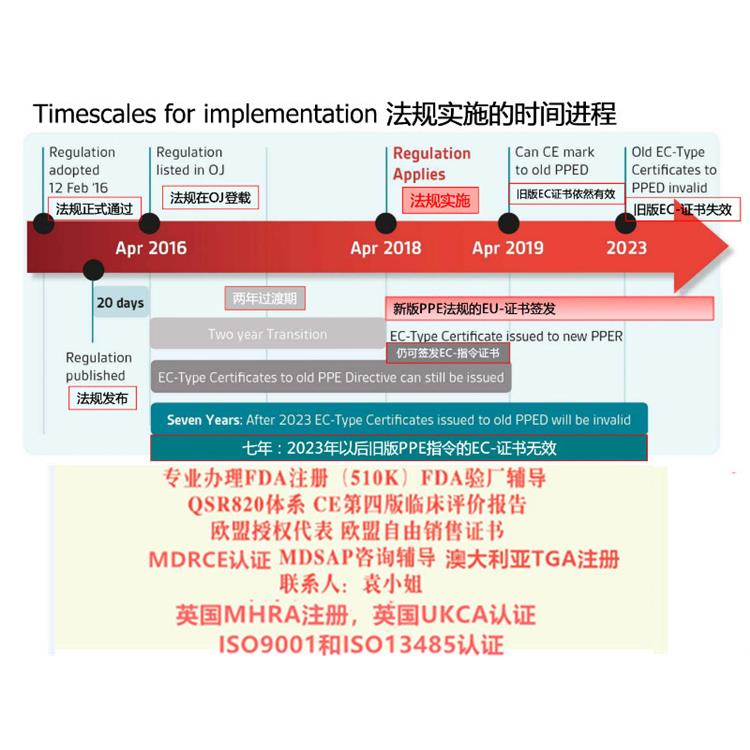
关于法规过渡期MDR 过渡期为3 年,共涉及四个时间点(见表1):欧盟器械新法规MDR主要变化情况介绍仅具有根据90/385/EEC 和93/42/EEC 指令签发的证书的器械可投放市场的前提是自MDR 适用之日起,其在设计和预期目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。
市场 (MDR第93~99条) 主管机构对器械的符合性特性和性能进行适当检查,包括酌情审查文件以及基于适当样品的物理或实验室检查。确保器械符合相关欧盟的相关要求,并且不危害健康、或公共利益保护的任何其他方面。
MDR 由指令升级为法规,提高了对欧盟成员国的约束力,具有直接约束性,无需各国转化为本国的法律法规的形式即可落实实施。内容上,MDR 在整合原指令的基础上,大幅提升了有关器械认证的规范和限制,例如关于产品分类规则、器械的可追溯性、性能研究的规范、增加上市后的产品性和有效性的等方面。MDR 共10 章123 条,并附有17 个附录。
市场 (MDR第93~99条) 主管机构对器械的符合性特性和性能进行适当检查,包括酌情审查文件以及基于适当样品的物理或实验室检查。确保器械符合相关欧盟的相关要求,并且不危害健康、或公共利益保护的任何其他方面。 主管机构应制定年度活动计划,并分配足够数量的胜任人力和物质资源以执行这些活动。
在此期间,仍然可以进行以下MDD证书的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户证书更新的相关活动;现有MDD客户证书更新的申请(包括提前更新的申请);