产品规格:
产品数量:
包装说明:
关 键 词:乳胶手套的SUNGO生产厂家
行 业:咨询 管理咨询
发布时间:2022-09-01
我们的核心资源包括分布在**主要经济体的运营网络,具有美国IAS认可资质的实验室,具有ANAB认可资质的认证机构,以及分布**的资源。依靠这些资源,我们为**的器械生产商和经营者提品全生命周期的市场准入服务。
*各国转换为法律法规即可实施。在内容方面,MDR基于原始指令的整合,大大改进了器械认证的规范和限制,例如产品分类规则,设备可追溯性,性能研究规范,上市后产品性提高以及有效性方面和。 MDR由10章和123篇文章组成,共17个附录。关于的过渡期:仅拥有根据指令90/385/EEC和93/42/EEC颁发的证书的设备可以投放市场,前提是自MDR应用之日起设计和预期用途没有发生重大变化且符合要求新规定。

按照附录VIII的规则所划分的器械风险等级 当前声明所涵盖的器械符合本法规,以及适用时其他相关的要求签署欧盟符合性声明的欧盟立法的声明 符合性声明中所用的任何通用规范的索引公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的证书的标识 如适用,额外的信息 签字人的声明,地址和日期、签字人姓名和职务、以及代签人签名
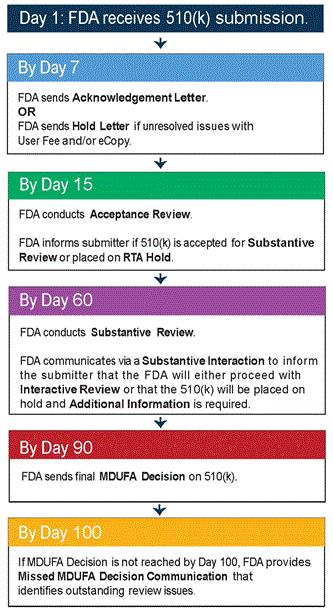
体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行。MDR将有源器械指令(现行的90/385/EEC)纳入了进来,与一般器械指令(现行93/42/EEC)合二为一,IVDR直接取代了现行的体外诊断器械指令98/79/EEC。主要事项:预计时间英文版MDR及英文版IVDR定稿 ,2017年一月底英文版MDR及IVDR在成员国发布欧盟其他语言MDR 及IVDR在成员国发布 ,2017年2月中欧盟会正式接受MDR及IVDR,2017年3月初欧洲议会正式接受MDR及IVDR,2017年4月初MDR及IVDR正式公开发布,017年4月底MDR及IVDR正式执行 2017年5月底MDR强制执行 ,020年5月底IVDR强制执行 , 2022年5月底MDR CE认证2016年12月14日,EUDAMED(European databank for medical devices) 筹划会上欧盟各国对于器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。

我们的服务包括: 确定您的器械在加拿大的具体分类。 代表您准备加拿大器械许可证(MDL)或加拿大器械机构许可证(MDEL)申请。 制定、实施或修改您的ISO 13485质量管理体系以满足加拿大的相关规定。 提供关于ISO 13485与加拿大器械法规(CMDR)方面的现场员工培训。 确定每年应向加拿大缴纳的许可证费用。 可以现场审计服务,确保符合ISO 13485:2003以及CMDR相关规定。 了解加拿大器械注册服务的更多信息,请联系我们
MDR对某些设备重新分类,范围更广。例如,MDR明确涵盖用于清洁、或其他设备的所有装置(*2.1条);一次性器械(*17条)};和某些无用途的装置(附件十六)。








