




价格:123.00起
0
联系人:
电话:
地址:
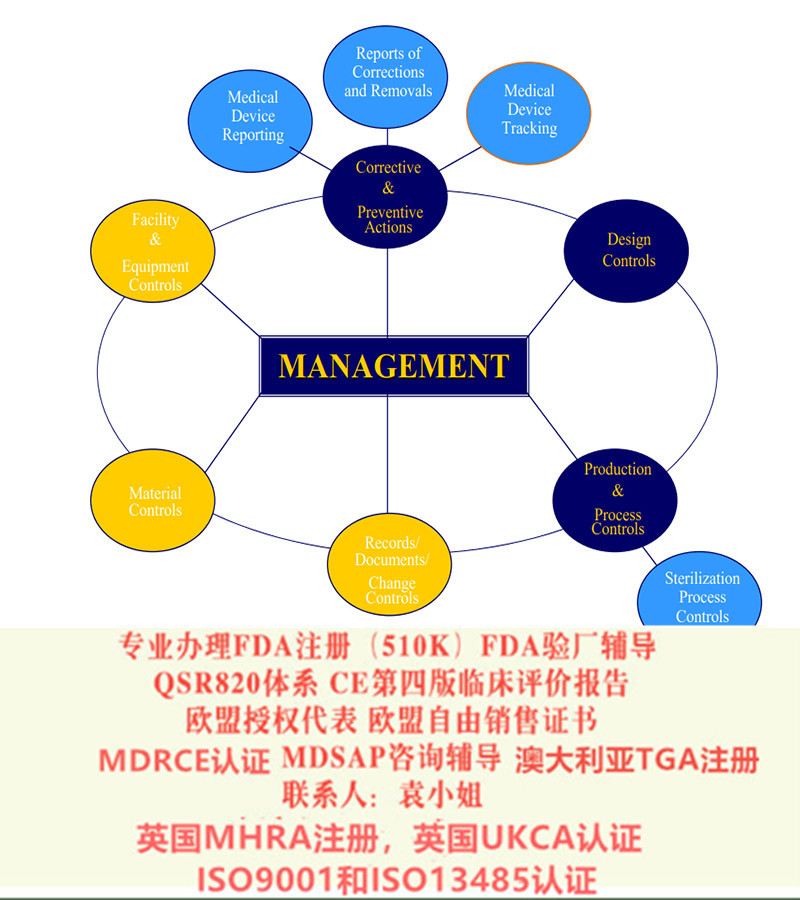
SUNGO始终追求支持、服务和客户满意。如何选择欧盟授权代表EAREAR并非特定授予的资质或认可,没有第三方评价资质可以参考。任何一个能够履行欧盟法规特定职责的欧盟成员国境内自然人或法人都能够成为EAR。但EAR不仅仅是提供了一个欧洲境内的注册地和响应代表,合格的EAR还应当:1)具有的法规和法律能力,帮助企业咨询、了解并响应欧盟法规;2)合法高效的帮助制造商在欧盟境内注册相应设备和器械;3)有充足的技术能力验证并评审企业技术文件,实施内部评审,降低质量风险;4)具有一个良好的公共关系纽带,有丰富的经验帮助制造商与欧盟有关部门沟通并解决问题;5)跟进法规更新,了解熟悉MDR,清晰识别EAR职责,有能力确保制造商符合最新要求。出于节约成本的考虑,制造商自己的进口商或贸易律师等都可以是EAR的选择之一。为了更好地符合欧盟要求以及减少风险,也可选择专业的EAR代理机构。充分考察EAR的沟通能力、响应时效、信息准确性、规模和品牌、行业口碑等,是选择合格EAR的重要依据。关于欧盟CE 认证的MDR法规升级:老指令MDD 93/42/EEC including 2007/47/EC 升级到新法规MDR EU 2017/7452017年5月,欧盟器械新法规MDR (REGULATION EU 2017/745) 颁布,新的法规将替代原有的器械指令 (MDD 93/42/EEC) 和有源植入性器械指令 (AIMDD 90/385/EEC) 。从2020年5月开始公告机构不能按照MDD颁发CE证,目前I*及以上风险等级产品认证机构已不再受理MDD指令的认证申请。对于目前获得CE证的企业,应基于自身设备的证据的充分性合理安排申请MDR的时间,尽快启动MDR法规合规准备事宜。MDR对于DOC的要求MDR 在其附录 IV中对DOC的内容作了明确的规定,至少包括如下内容:制造商名称、注册商品名或注册商标和单一注册号(如签发)及其授权欧盟代表(如适用)和注册营业地点的联系制造商对签发欧盟符合性声明负完全责任的声明附录VI第C部分所所述的基本的器械标识UDI - DI产品名称和商品名、产品代码、目录编号或欧盟符合性声明中包含的其他允许识别和追溯产品的明确的参考号,如适当照片,以及适当时其预期目的。除产品或商品名称外,第3条中基本UDI – DI所提供的允许识别和可追溯产品的信息按照附录VIII的规则所划分的器械风险等级当前声明所涵盖的器械符合本法规,以及适用时其他相关的要求签署欧盟符合性声明的欧盟立法的声明符合性声明中所用的任何通用规范的索引公告机构的名称和标识号(如适用),所执行的符合性评估程序的说明和所签发的证的标识如适用,额外的信息签字人的声明,和日期、签字人姓名和职务、以及代签人签名按照MDR的附录VIII划分为普通I类的产品(非灭菌、非重复使用、无测量功能的I类产品)无需公告机构介入,制造商可以进行自我符合性声明。在这种情况下,DOC的内容与上面所述的公告机构介入的情况有所不同,比如公告机构的名称和标识号就不适用。对于需要公告机构介入的器械,符合性声明的签署通常是符合性评定程序的后一步。在未取得公告机构签发的CE证之前,制造商无法签署正式的DOC文件。不过制造商可以先起草一份DOC的草案提供给公告机构审查。而对于无需公告机构介入的器械,制造商在法规所要求的产品符合基本要求的证据准备充分后,即可签署DOC。DOC作为法规要求的重要文件,制造商应该按照质量管理体系中文件控制程序的要求进行管控。DOC中任何内容发生了变更,则需重新签发。特别需要注意的是,对于由公告机构发证的产品,DOC中任何内容的变更,都需得到原发证公告机构的评审和批准。1. 基于欧盟的器械法规MDR 2017/745的规定,医用口罩,手术衣,隔离衣等产品如果是非灭菌的,那么在欧盟属于I类, 这些均属于制造商自我声明产品。制造商应按相关指令要求:维护CE技术文件、发布符合性声明、确定欧盟授权代表,完成产品在欧盟主管当局的注册之后便可以贴加CE标志,欧洲销售。SUNGO 提供的服务包括:1)提供欧盟授权代表,授权在标签和说明书中使用EU REP 信息2)修订和编制符合MDR 的CE技术文件3)申报欧盟注册4)企业编订符合声明:无论按照MDD指令或者MDR法规,口罩、隔离服等产品均属于I类产品。如果产品是非无菌的,根据MDD或MDR要求,I类非无菌器械无需公告机构介入。I类非无菌产品出口欧盟要求:1. 编制CE技术文档2. 产品送检,取得产品检测报告3. 出具自我符合性声明4. 由欧代在其所在欧盟成员国主管当局(如CIBG、MHRA)进行信息注册并保存制造商的技术文档副件。5. 在产品包装、标签上标记CE标志2) I类无菌器械:若产品是I类无菌器械,则需要公告机构介入,有一个较长的审核周期。I类无菌器械销往欧盟要求:1. 编制产品技术文档2. 建立ISO13485体系3. 产品送检,取得产品检测报告4. 接受公告机构的现场质量体系审核和技术文档审查5. 获得具备相应的公告机构出具的CE认证6. 由欧代在其所在欧盟成员国主管当局(如CIBG、MHRA)进行信息注册并保存制造商的技术文档副7. 在产品包装、标签上标记带有公告机构号的CE标志SUNGO可以在过渡期内为提供新旧法规的咨询服务,包括:协助判定产品分类协助选择合理的符合性途径协助选择合适的认证机构制定认证的解决方案协助完成评估编写CE技术文件欧盟代表服务