产品规格:
产品数量:
包装说明:
关 键 词:成都化妆品FDA代理
行 业:商务服务 咨询服务 产品检测服务
发布时间:2023-12-17
什么是美国FDA认证?
对于不少亚马逊卖家而言“FDA认证”,可能并不陌生,因为某些品类在上架亚马逊平台时,被强制要求需要提供相关的FDA测试报告和FDA注册编号。美国FDA机构与每一位美国公民的生活都息息相关。在国际上,FDA被公认为是世界上更大的食品与药物管理机构之一。其它许多都通过寻求和接收FDA的帮助来促进并其该国产品的。
FDA注册是否一定需要一位美国代理人?
是的,中国申请人在进行FDA注册时必须指派美国机构作为其代理人,该名代理人负责进行位于美国的过程服务,是联系FDA与申请人的媒介。我们可以更帮助您解决FDA注册难题!
FDA认证
如果您想办理可以联系代理办理FDA认证,办理流程如下:
1.提品信息,判定并确定申请路径(可以来电咨询了解);
2.填写FDA申请表;
3.签署合约并支付代理费用;
4.支付美金到美国FDA;
5.提交注册申请资料给美国FDA审批;
6.注册审批完成,获得批准号码;
7.颁发注册证明书;
8.时间2周左右。
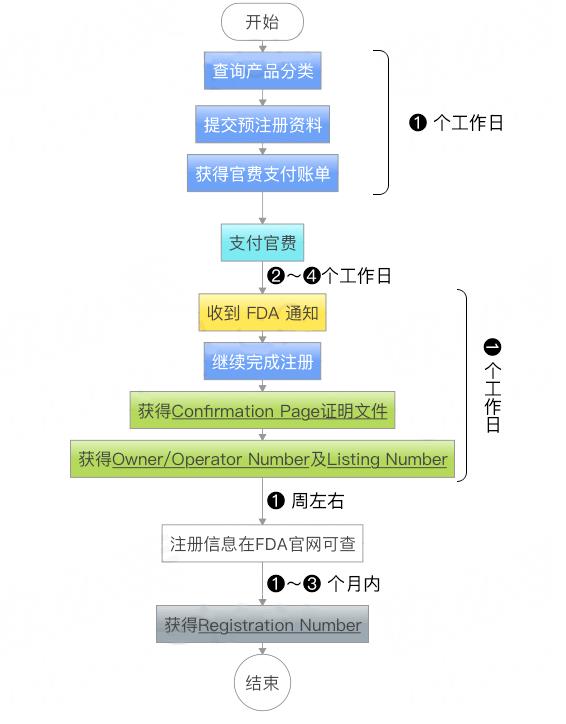
食品和药物管理局(FDA)主管:食品、药品(包括兽药)、医疗器械、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验;也包括化妆品、有的产品、组合产品等与人身健康有关的电子产品和医疗产品。产品在使用或消费过程中产生的离子、非离子影响人类健康和项目的测试、检验和出证。根据规定,上述产品必须经过FDA检验证明后,方可在市场上销售。FDA有权对生产厂家进行视察、有权对违法者提出起诉。

1-1.企业登记 a)企业注册申请表 b)FDA确认,发布企业序列号;
1-2.产品注册 1.2.1医疗器械产品以风险程度分成3类: a)1类 医疗器械列名控制 b)2类 市场准入认可(即510(K)认可) c)3类 PMA入市前批准
1.2.2委托代理 《FDA注册与通报委托协议》(法人代表签字,加盖公司公章)
1.2.3提供资料 a)企业法人营业执照 b)事业法人代码证书,社团法人登记证等 (复印件加盖公司公章) c)有效期内的资质证明或生产许可证证书(复印件加盖公司公章) d)《FDA注册申请表》(中,英文各一份,加盖公司公章) e)FDA新增加要求提交的其他文件(如有)。 f)企业简介(企业成立时间、经济性能、技术力量、主要生产品种及其性能、资产状况)。
1-3.付款 注册和列名免费; 510(K)、PMA需按FDA网上公布的收费标准支付。
1-4.办理注册 收费后计算, FDA60个工作日完成注册;
1-5. FDA网站公布告知注册情况 ,510(K)、PMA的FDA另发送批准准入信件。
2. 医疗器械510(K)申请文件
2-1 医疗器械510(K)文件也即FDA对PMN所需的文件,因其相应FD&CAct* 510(K)章节,故通常称510(K)文件。
对510(K)文件所必须包含的信息,FDA有一个基本的要求,其内容大致如下16个方面:
1) 申请函,
2) 目录,
3) 真实性保证声明;
4) 器材名称;
5) 注册号码;
6) 分类;
7) 性能标准;
8)产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等。
9)实质相等性比较(SE)
10)510(K)摘要或声明
11)产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等
12)产品的性与有效性,包括各种设计、测试资料
13)生物相容性
14)色素添加剂(如适用)
15)软件验证(如适用)
16),包括方法的描述、验证、产品包装和标识等
2-2 同质性比较(SE)
a)同质性比较是要证明所申请上市的产品和已在美国市场上合法销售的产品在性和有效性方面比较是实质相等的
b)选择合适的产品进行比较是510(K)申请的关键步骤。在进行比较时应从如下方面进行考虑:
c)企业必须提供充足的资料证明,所申请上市的器械和被比较的器械是实质相等的(SE),否则510(K)申请不会通过。
我们的优势
雄厚的技术实力:拥有医疗器械背景的技术人员组成
国际化服务水平:多种语言的客户服务人员,服务国际客户
丰富的合规经验:拥有多年中国、美国、欧洲等国的法规研究经验,可以同时支持中、美、欧三国法规的应对
优越的资源:和国内外众多优秀实验室合作,为企业量身设计专业的测试方案,提供优质的服务
良好的关系渠道:能够地与机构进行沟通,显著提高服务质量和效率








